Kimyasal Bağ Kavramının Tarihsel Gelişimi
Kimyasal Bağ Kavramının Tarihsel Gelişimi :
- Empedokles'e göre; tabiatta bulunan 4 elementi (toprak, hava, ateş, su) bir arada tutan güç "aşk" ve birbirinden ayıran güç ise "nefret" tir.Tabiatta madde ve kuvvet iki ayrı ilkedir.
- Empedokles’in açıklamaları yaklaşık 2000 yıl geçerliliğini korumuştur.
- Atom fikrini ilk ortaya atan kişiler Leucippus ve Democritus'tur.
- Daha sonra bu düşünürlerin fikirlerini Epicurus desteklemiştir.
- Bu üç Yunanlı düşünüre göre maddelerin sertlik esneklik sertlik tat şekil gibi özelliklerini belirleyen atomlardır. Örneğin tuz; atomları tuzlu olduğu için tuzludur.
- Demokritus’a göre her bir atomun şekil ve büyüklüğü diğerlerinden farklıdır.
- Bazı atomlarda çengeller ve yuvalar bazılarında ise toplar ve oyuklar vardır. Atomlar bir araya geldiğinde çengellerin birbirine takılması ya da topların oyuklara girmesiyle atomlar bir arada tutulur.
- Bugün için saçma görünmesine rağmen o zaman için atomların bağlanma fikrini ortaya atması açısından Democritus’un fikirleri çok önemlidir.
- 17. Yüzyılın ortalarında Fransız bilim adamı Descartes bu görüşleri yeniden gündeme getirdi ve su molekülünün oluşumunu açıklamak için kullandı.
- Dalton atom teorisine göre Democritus ve Descartes’ ın fikirleri kabul edilemez. Çünkü Dalton atomları bölünemez ve içi dolu küreler olarak tanımladı.
- Ancak küre şeklindeki taneciklerin bir arada tutunması ve değişik şekiller verilebilmesi mümkün görünmüyordu.
- Bu nedenle Dalton Atom Teorisi ile atomların bağlanma olgusu açıklanamadı ve bu durum Dalton Atom Teorisinin en büyük eksiği olarak kabul edildi.
- Benjamin Franklin'in yıldırım ile yaptığı deneyler ve statik elektrik ile ilgili yaptığı deneyler sonucunda maddelerde yüklü taneciklerin bulunması gerektiği fikri ortaya çıktı.
- Stone atomun yapısında olduğuna inanılan eksi(–) yüklü tanecikleri "elektron" olarak tanımladı.
- Bununla birlikte atomların daha küçük taneciklerden oluşmuş olması hipotezi çok yaygınlaşmıştır.
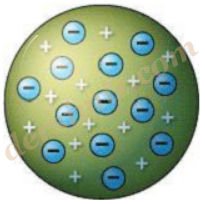 Thomson Atom Modeli : Thomson "Atomlar atom altı taneciklerden oluşur" hipotezi doğrultusunda kendi teorisini geliştirmiş, atomlar "artı(+) ve eksi(–) yüklü tanecikler içerir ve bu yükler atomun içerisinde eşit olarak dağılmışlardır.” demiştir. dersimiz.com
Thomson Atom Modeli : Thomson "Atomlar atom altı taneciklerden oluşur" hipotezi doğrultusunda kendi teorisini geliştirmiş, atomlar "artı(+) ve eksi(–) yüklü tanecikler içerir ve bu yükler atomun içerisinde eşit olarak dağılmışlardır.” demiştir. dersimiz.com
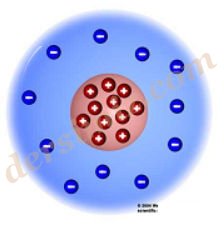 Rutherford Atom Modeli : Thomson'un öğrencisi olan Rutherford kendi atom teorisini ortaya attı ve "Atomda proton adı verilen artı(+) tanecikler çekirdek denilen kısımda toplanmışlardır. Elektron adı verilen eksi(–) yüklü tanecikler ise çekirdeğin etrafında dağılmışlardır." dedi.
Rutherford Atom Modeli : Thomson'un öğrencisi olan Rutherford kendi atom teorisini ortaya attı ve "Atomda proton adı verilen artı(+) tanecikler çekirdek denilen kısımda toplanmışlardır. Elektron adı verilen eksi(–) yüklü tanecikler ise çekirdeğin etrafında dağılmışlardır." dedi.
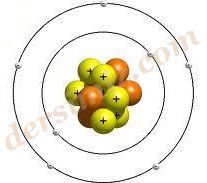 Bohr Atom Modeli : Rutherford atom modelindeki eksiklikleri Bohr kendi atom modeli ile kapatmaya çalıştı. Bohr’a göre "Atomun çekirdeğinde artı(+) yüklü protonlar bulunur. Elektronlar ise çekirdekten belli uzaklıklardaki katmanlarda sürekli hareket halindedir. Isı ve ışığın etkisiyle bu elektronlar çekirdekten uzaklaşabilir. Elektron tekrar eski katmanına dışarıya ışık yayar."
Bohr Atom Modeli : Rutherford atom modelindeki eksiklikleri Bohr kendi atom modeli ile kapatmaya çalıştı. Bohr’a göre "Atomun çekirdeğinde artı(+) yüklü protonlar bulunur. Elektronlar ise çekirdekten belli uzaklıklardaki katmanlarda sürekli hareket halindedir. Isı ve ışığın etkisiyle bu elektronlar çekirdekten uzaklaşabilir. Elektron tekrar eski katmanına dışarıya ışık yayar."
- Bu atom teorisiyle birlikte atomların birbirine bağlanabilirliği açıklanabilir oldu.
- Bugün biliyoruz ki kimyasal bağ; atomların elektron alış verişleri veya ortaklaşa kullanmalarıyla oluşmuştur.
Ekleyen : dersimiz.com