Gazlar ve Özellikleri -2
GAZLAR 2
İDEAL GAZ DENKLEMİ
P.V=n.R.T
P: Basınç (atm),
76 cm Hg = 760 mm Hg = 1 atm eşitliği unutulmamalıdır.
V: Hacim (ℓt)
n: Mol sayısı
R: Raydberg gaz sabiti olup bütün gazlar için
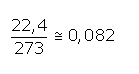 litre.atm/mol.°K
litre.atm/mol.°K
T: Sıcaklık birimi olarak daima kelvin kullanılır.
Kelvin = °C + 273 eşitliği vardır.
Örnek - 1
2 mol H2 gazının 5,6 lt'lik bir kapta 8 atm. basınç yapması için sıcaklığı kaç °C olmalıdır?
Çözüm:
P.V = n.R.T denkleminden;
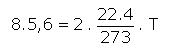
T= 273 °K çıkmalıdır.
Kaç °C olduğu sorulduğundan °K = °C + 273 eşitliğinden gazın sıcaklığı 0°C olacaktır.
GAZLARIN YOĞUNLUĞU
Gazların yoğunluğu basınç ve sıcaklık değişimi ile değişir.
P . V = n . R . T denkleminde;
Mol sayısını gram cinsinden yazarsak,
gazın mol sayısı; gaz kütlesinin, gazın mol ağırlığına oranına eşittir.
p.MA = d.R.t formülü çıkarılabilir.
Yoğunlukla ilgili sorularda bu eşitlik kullanılmalıdır.

Örnek - 2
N2 gazının normal koşullarda yoğunluğu 1,25 g/lt dir.
N2 gazının 0,2 atmosfer 273 °C’deki yoğunluğu kaçtır? (N : 14)
Çözüm :
P.MA = d.R.T denklemindeki sabit olan
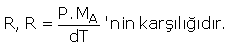
Şartlar değişsede R değişmeyeceğinden,
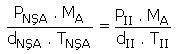
Aynı gaz olduğu için MA’lar sadeleşir. Verilenler yerine yazılırsa
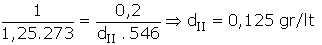
GAZLARIN KARŞILAŞTIRILMASI
Farklı gazlar birbiriyle karşılaştırıldığında ya da herhangi bir gazın farklı ortamlardaki halleri birbiriyle kıyaslandığında;

Buradan genel olarak aşağıdaki formül çıkarılır.
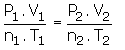
Formül karşılaştırma sorularında kullanılacaktır.
Örnek - 3
2 litre hacimli kapta mutlak sıcaklığı T olan m gram CH4 gazı, 3 litre hacimli kapta mutlak sıcaklığı 2T olan 2m gram SO2 gazları vardır.
SO2 gazının basıncının CH4 gazı basıncına oranı kaçtır?
(H : 1, C : 12, O : 16, S : 32)
Çözüm

Örnek - 4
Aşağıdaki grafiklerden hangisi yanlış çizilmiştir?
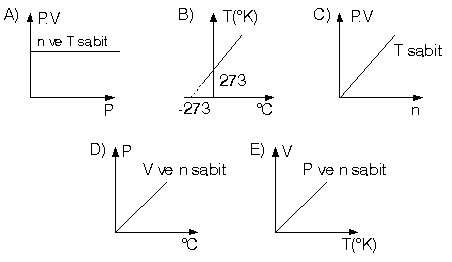
Çözüm:
P.V = n.R.T denklemi esas alınarak yorumlanırsa A, B, C, E şıklarında çizilmiş olan grafikler doğru çizilmiştir. D şıkkında ise basınç, °C grafiği, gazın sıcaklığı 0 °C iken
273°K'dır. Basıncı sıfır olamaz. Yani grafik sıfır noktasından başlayamaz.
Cevap D
Ekleyen : dersimiz.com