Birleşen Hacim Oranları Kanunu
BİRLEŞEN HACİM ORANLARI KANUNU
Dalton Atom Teorisi ile Kimya bilim tarihinde çığır açan John Dalton atmosfer olaylarını incelemeye başladı ve bu konu ile ilgili deneyler yaptı.
Aynı yıllarda gazlarla ilgili başka bilim adamlarının da çalışmaları başladı.
 1787’de Fransız Fizikçi Jacques Charles yaptığı deneylerde sabit basınçtaki belli bir miktar gazın hacminin sıcaklık arttıkça arttığını keşfetti.
1787’de Fransız Fizikçi Jacques Charles yaptığı deneylerde sabit basınçtaki belli bir miktar gazın hacminin sıcaklık arttıkça arttığını keşfetti.

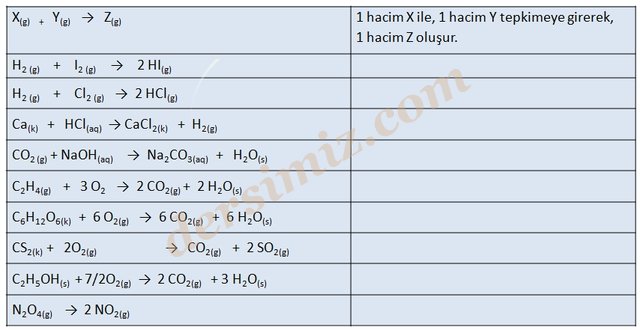
Gazların bu özelliği Joseph Gay-Lusac’ın da dikkatini çekti ve gazlarla ilgili araştırmalar yaptı. 19. yüzyılın başlarında gazlarla ilgili yapmış olduğu deneylerin sonuçlarını yayımlayan Gay Lussac; Gazların birleşen hacimleri arasındaki oranın gazların birleşen tanecik sayıları arasındaki oranı verdiğini ileri sürdü.
Ancak bu teori Dalton tarafından kabul edilmedi. Dalton elementlerin atomik yapılı olduğunu düşünüyor, yapılı olamayacağını söylüyordu. Bundan dolayı suyun oluşma denkleminin şu şekilde olduğunu söylüyordu :
H + O → HO
1 tanecik 1 tanecik 1 tanecik
1 hacim 1 hacim 1 hacim
Dalton bu söylediklerine deneysel verilerle ulaşamadı. Deney sonuçları söylediği oranlarda çıkmadı.
Bu soruna Avogadro açıklık getirdi. İtalyan Fizikçi Amedeo Avogadro , Dalton ve Gay-Lussac yasalarından yola çıkarak gazlarla ilgili yaptığı deneyler sonucu ; gaz halindeki elementlerin bazılarının atomik yapılı, bazılarının ise molekül yapılı olabileceğini düşündü ve "Aynı sıcaklık ve basınçta, gazların eşit hacimlerinde eşit sayıda atom ve molekül içerir." diyerek, Avagadro hipotezini ortaya attı ve kimya tarihine bu şekilde molekül kavramı da girmiş oldu.
Bunun sonucu olarak Gay Lussac tarafından ifade edilen ; "Sabit basınç ve sıcaklıkta gazların birleşen hacimlerinin oranı tanecik sayılarının oranını verir." yargısını doğrulanmış oldu.
H2(g) + Cl2(g) → 2HCl(g)
1 tanecik 1 tanecik 2 tanecik
1 hacim 1 hacim 2 hacim
N2(g) + 3H2(g) → 2NH3(g)
1 tanecik 3 tanecik 2 tanecik
1 hacim 3 hacim 2 hacim
2H2(g) + O2(g) → 2H2O(g)
2 tanecik 1 tanecik 2 tanecik
2 hacim 1 hacim 2 hacim
Ekleyen : dersimiz.com